استخدام النقط كرموز
للإلكترونات Electron-dot Symbols
تمهيد :
ابتدع العالم لويس طريقة بسيطة في تمثيل الذرات والكترونات التكافؤ
وما يطرأ عليها من تغيرات عندما ترتبط مع عناصر أخرى وتكون المركبات وذلك
باستخدام النقط كرموز للإلكترونات .
جيلبرت
نيوتن لويس
(
Gilbert Newton
Lewis 1875 – 1946
)
هو عالم
أمريكي أكسبته أعماله واكتشافاته ونظرياته في كثير من موضوعات الكيمياء
العامة والفيزيائية شهرة عالمية وجعلته من علماء الكيمياء المرموقين في
القرن العشرين . وضع لويس مفهوم الرابطة الكيميائية الحديث ، وصنف الروابط
إلى أيونية ومشتركة، وبحث وأسس لنظريات الربط الحديثة . درس أيضاً
الديناميكا الحرارية
Thermodynamics
وأسهم في وضع الكثير من قوانينها . وضع تعريفاً ونظرية خاصة بالحموض
والقواعد ما تزال معمولاً بها حتى يومنا هذا . وعند دراسته للروابط وضع
العديد من المفاهيم الحديثة منها مفهوم الكترونات التكافؤ ، وقاعدة
الاستقرار الالكتروني أو قاعدة الثمانية (
ربط
) كما اقترح النظام البسيط في تمثيل الالكترونات بالنقط عند كتابة رموز
العناصر والأيونات البسيطة وعند كتابة صيغ المركبات والأيونات المعقدة .
توفي سنة 1946 وهو يعمل في إحدى التجارب المخبرية .
|
 |
طريقة لويس في تمثيل الكترونات التكافؤ بالنقط
أطلق لويس
على الكترونات المستوى الخارجي للذرة الأبعد عن النواة اسم الكترونات
التكافؤ أو الكترونات الربط ، وهذه الالكترونات هي المسؤولة عن عمل الروابط
الكيميائية مع ذرات من نفس النوع لتكوين الجزيئات المتشابهة مثل
H2
، S8
، أو مع ذرات عناصر أخرى وتكوين المركبات الكيميائية مثل
CO2
،
NaCl
.
ابتدع لويس
طريقة بسيطة في تمثيل الكترونات التكافؤ (
الربط
) ، وهي
الكترونات عندها بعض من حرية الحركة . بسبب بعدها عن النواة لذا يمكنها أن
تفلت من جذب نواة الذرة كلياً أو جزئياً ، وعندما يحدث ذلك تعمل علاقات
جديدة (
روابط
) تجعل
الذرات في وضع أكثر استقراراً واتزاناً .
تطبق طريقة
لويس في التعبير عن الالكترونات بالنقط في موضوعات وكتب الكيمياء ، ومن
المستحيل أن تجد كتاب كيمياء لا يستعملها أو يشير إليها .
وسنوضح هذه
الطريقة بالأمثلة المباشرة
أولاً : العناصر والأيونات ،
استعن بالجدول الدوري
Na
|
|
الأولى
(IA
)
|
|
11
|
|
11
|
|
1
(
واحد
)
|
|
أنه يمثلها
بالرمز
Na
.
|
الرمز
Na
هو رمز الصوديوم المتفق عليه دولياً وهو هنا
(
بحسب لويس
) يمثل
نواة ذرة الصوديوم والكتروناته الداخلية العشرة ، أما النقطة بقرب الرمز
فهي رمز الكترون التكافؤ الخاص به . عدد الكترونات التكافؤ لذرة الصوديوم
هو (
1 ) وهو
يدل على المجموعة الأولى التي ينتمي إليها الصوديوم في الجدول الدوري .
نعلم أن
الصوديوم يفقد هذا الالكترون عند دخوله في تفاعل كيميائي مع عنصر آخر ،
وعند ذلك تنتج ذرة صوديوم مشحونة بشحنة موجبة واحدة لأن عدد البروتونات (
+ 11
) ، بقي
كما هو بينما أصبح عدد الالكترونات (
10 ) .
نسمي ذرة
الصوديوم المشحونة باسم أيون الصوديوم
Sodium
Ion
ويصبح رمزها حسب لويس
[ Na ]+
دون نقط أي دون الكترونات لأنها فقدت الكترون التكافؤ الوحيد الخاص بها .
| K | |
| 19 | |
| K . | |
+
[ K ]
|
|
أكمل الفراغين في العبارة :
أيون البوتاسيوم ــــ ويصبح توزيعه الإلكتروني مشابهاً لتوزيع غاز
ـــ النبيل القريب منه .
مثال (2)
:
الكلور
|
||
Cl
|
||
السابعة
(
VII A )
|
||
(17) سبعة عشر
|
||
(17) سبعة عشر
|
||
(7) سبعة
|
||
إنه يمثلها
بالرمز
|
||
ومعنى هذا
التمثيل هو أن الرمز المتفق عليه دولياً
Cl
يمثل نواة ذرة
الكلور والكتروناته الداخلية العشرة . أما
النقاط السبع حول الرمز فهي تمثل الكترونات التكافؤ لذرة الكلور وهي تدل
على أن الكلور من عناصر المجموعة السابعة في الجدول الدوري .
نعلم أن ذرة الكلور الواحدة تكسب الكتروناً عند دخولها في تفاعل كيميائي مع
عنصر فلزي (
مثل
الصوديوم
) وعند
ذلك يزيد عدد الالكترونات الخارجية فيصبح ثمانية وتصبح ذرة الكلور مشحونة
بشحنة سالبة ( لأن عدد البروتونات فيها 17 بينما أصبح عدد الإلكترونات 18
)
، نسمي ذرة الكلور المشحونة باسم أيون الكلوريد ونمثله حسب لويس كما يلي :
 |
وقد مثلنا
الإلكترون الجديد بلون آخر لمجرد التوضيح والتذكير بأنه أتى من ذرة أخرى .
|
ثال (3)
:
الأكسجين
|
||
O
|
||
السادسة
( VI A )
|
||
( 8
)
ثمانية
|
||
| ( 6 ) ستة | ||
ماذا يحدث لو كسبت ذرة
الأكسجين الكترونين من ذرة أخرى ؟
إنها تصبح
|
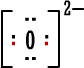 |
ذرة أكسجين مشحونة ونسميها أيون الأكسيد . |
7N
|
( 7 هو العدد الذري ) وأيون النيتريد | [ N ]-3 |
بطريقة لويس
.
|
ذرة
النيتروجين
|
أيون
النيتريد
|
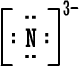 |
ب) مثِّل ذرة المغنيسيوم
|
12Mg
|
وأيون
المغنيسيوم
|
[ Mg ]2+ |
بطريقة لويس
.
|
ذرة المغنيسيوم
|
. Mg . |
أيون المغنيسيوم
|
[Mg]2+ |
 |
تنويه : نلفت نظر الدارسين
إلى ملاحظة هامة نوضحها بالأمثلة اللاحقة .
|
في حالة
الأيون الموجب يبقى اسم العنصر كما هو ، أما في حالة الأيون السالب فنستبدل
الأحرف الأخيرة من الاسم بالأحرف
ide
وبالعربية (
يد
) .
| رمز لويس للعنصر أو الأيون |
الاسم بالانجليزية
|
الاسم بالعربية | |
ذرة متعادلة
|
Na .
|
Soduim
|
صوديوم |
أيون
|
+
[ Na ]
|
Soduim
Ion
|
أيون الصوديوم |
ذرة متعادلة
|
Chlorine
|
كلور | |
أيون
|
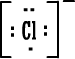 |
Chloride Ion
|
أيون كلوريد |
ذرة متعادلة
|
Oxygen
|
أكسجين | |
أيون
|
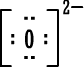 |
Oxide
Ion
|
أيون
الأكسيد
|
نستخدم
طريقة لويس في التعبير عن الذرات ونوسعها لتشمل الأيونات والمركبات
الكيميائية سواء أكانت الرابطة فيها من النوع الأيوني أم المشترك ، كما
نستخدمها للتعبير عن مجموعات العناصر في الجدول الدوري بطريقة بسيطة نوضحها
فيما يلي .
تمثيل مجموعات العناصر في
الجدول الدوري والأيونات التي تنتج عنها بطريقة الإلكترونات النقطية.
سنعطي للعنصر رمزاً عاماً هو
X.
| المجموعة | تمثيل لويس للعنصر | تمثيل لويس للأيون | مثال للعنصر |
الأولى
|
X+ | ||
الثانية
|
X2+ | ||
الثالثة
|
X3+ | ||
الرابعة
|
عناصرها تكون روابط مشتركة ونادراً ما تكون روابط أيونية
|
||
الخامسة
|
كما هو الحال مع المجموعة الرابعة
|
||
السادسة
|
|||
السابعة
|
|||
الثامنة
|
مجموعة الغازات النبيلة ، الذرات مستقرة لأن عدد الكترونات
التكافؤ ثمانية
|
لاحظ أن قاعدة الثمانية التي وضعها لويس والتي نصها :
(
حتى
تستقر الذرات يجب أن يحاط مدارها الأخير بثمانية الكترونات
) . هي
نتيجة لما كان علماء الكيمياء قد درسوه ولاحظوه على عناصر الغازات النبيلة
(
المجموعة الثامنة
) من
قلة النشاط الكيميائي ، حيث لا تبدي رغبة في التفاعل مع غيرها من العناصر
وتكوين المركبات ، وهذا ما جعل لويس يعتبرها نموذجاً ومثالاً يحتذى للعناصر
الأخرى النشطة والفعالة ، التي يكون في ذراتها عدداً من الإلكترونات غير
المزدوجة ، وعندما تتحد مع بعضها وتكوّن مركبات تربط بينها روابط مشتركة أو
أيونية تزدوج الكتروناتها ويصبح التوزيع الإلكتروني للواحد منها مشابهاً
للتوزيع الإلكتروني للغاز النبيل الأقرب إليه ، فأيون الصوديوم والمغنيسيوم
يصبح توزيعها الإلكتروني مشابهاً للنيون . وأيون الكلوريد يصبح توزيعه
مشابهاً للأرجون القريب منه .
ثانياً :
أمثلة على استخدام طريقة لويس في تمثيل الجزيئات المتشابهة
| 1. جزيء |
H2
|
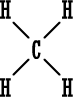
ذرة الهيدروجين عندها الكترون تكافؤ واحد . | ||||
H : H
|
هنالك طريقة أخرى لرسم الكترون الربط هي الشرطة فتكتب H – H بدلاً من H . . H | |||||
| والمعنى واحد ، وتستخدم في مساقات الكيمياء ، والكتب الطريقتين الواحدة بدل الأخرى . | ||||||
| 2. جزيء |
O2
|
الكترونات تكافؤ الأكسجين ( 6 ) . | ||||
|
||||||
| يوجد رابطتان بين ذرتي الأكسجين المكونتين للجزيء ، لاحظ أن قاعدة الثمانية قد انطبقت على جزيء الأكسجين . | ||||||
| 3. جزيء |
N2
|
الكترونات التكافؤ لذرة النيتروجين ( 5 ) . المجموع 10 الكترونات . | ||||
| يوجد ثلاث روابط بين ذرتي النيتروجين المكونتين لجزيء النيترروجين . | ||||||
| أو | ||||||
| انطبقت قاعدة الثمانية على جزيء النيتروجين . | ||||||
نتيجة : قد تكون الرابطة المشتركة ( التساهمية ) من :
أ.
الدرجة الأولى كما هو الحال في مثال الهيدروجين .
ب.
الدرجة الثانية كما هو الحال في مثال الأكسجين .
ج.
الدرجة الثالثة كما هو الحال في مثال النيتروجين .
ثالثاً : أمثلة على تمثيل المركبات
ذات الرابطة المشتركة بطريقة لويس :
|
1- مثال ( 1 ) :
الماء
H2O
عدد
الكترونات تكافؤ الأكسجين ( 6 ) .
عدد
الكترونات تكافؤ الهيدروجين ( 1 ) .
(
مجموع
عدد الكترونات التكافؤ
8
) .
|
||||||
|
2- مثال ( 2 ) : غاز
الميثان
CH4
عدد
الكترونات تكافؤ الكربون ( 4 ) .
عدد
الكترونات تكافؤ الهيدروجين ( 1 ) ويوجد منه (4 ) ذرات إذن عدد الإلكترونات
( 4 ) .
مجموع عدد
الكترونات تكافؤ ( 8 ) .
|
||||||
|
3- مثال ( 3 ) : غاز كلوريد الهيدروجين
HCl
عدد
الكترونات تكافؤ الكلور ( 7 ) .
عدد
الكترونات تكافؤ الهيدروجين ( 1 ) .
مجموع عدد
الكترونات التكافؤ ( 8 ) .
|
||||||
|
4- مثال ( 4 ) : ثاني أكسيد الكربون
CO2
عدد
الكترونات تكافؤ الأكسجين ( 6 ) ، ويوجد منه ذرتان ، مجموع الكتروناتها (
12 ) .
عدد
الكترونات تكافؤ الكربون ( 4 ) .
مجموع عدد
الكترونات التكافؤ ( 16 ) .
|
||||||
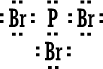
|
5- مثال ( 5 ) : بروميد الفوسفور
PBr3
الكترونات
تكافؤ الفوسفور ( 5 ) .
الكترونات
تكافؤ البروم ( 7 ) ويوجد منه ثلاث ذرات مجموع الكتروناتها ( 21 ) .
مجموع
الكترونات التكافؤ ( 26 ) .
|
رابعاً : تمثيل
المركبات الأيونية بطريقة لويس وبالطريقة المختصرة :
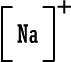
أيون
الصوديوم
|
 |
أيون
الكلوريد
|
 |
كلوريد
الصوديوم
|
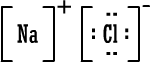 |
وباختصار
NaCl
(
المركب متعادل ، لماذا ؟
)
مركب كلوريد الصوديوم متعادل لأن
شحنة أيون الصوديوم الموجبة تعادل شحنة أيون الكلوريد
السالبة.
أيون
المغنيسيوم
|
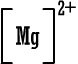 |
أيون
الأوكسيد
|
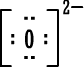 |
أكسيد
المغنيسيوم
|
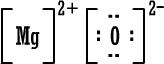 |
وباختصار
MgO
( المركب متعادل ، لماذا ؟
)
كالسابق شحنة
أيون المغنيسيوم تعادل شحنة أيون الأكسيد .
أيون
الألومنيوم
|
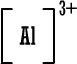 |
أيون
البروميد
|
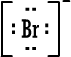 |
بروميد
الألومنيوم
|
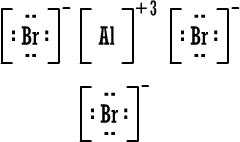 |
أما صيغة
بروميد الألومنيوم باختصار فهي
AlBr3
( المركب متعادل ، لماذا ؟ )
الشحنة الناتجة عن ثلاث أيونات بروميد ( 3 × -1 ) تعادل شحنة أيون
الألومنيوم الثلاثية الموجبة .
خامساً : تمثيل لويس لمركبات تحوي عدداً فردياً من الإلكترونات
يكوِّن النيتروجين عندما يتحد بالأكسجين خمسة أكاسيد معروفة ومدروسة ، ولكن
صيغ البعض منها ما تزال موضع دراسة عند علماء الكيمياء ، إن اثنين من هذه
الأكاسيد تحوي عدداً فردياً من الألكترونات وهي :
1- أكسيد النيتريك أو أكسيد النيتروجين (
II
)
وصيغته
المختصرة
NO
.
وهنا عدد الكترونات تكافؤ النيتروجين ( 5 ) .
عدد الكترونات تكافؤ الأكسجين ( 6 ) .
إذن مجموع الكترونات التكافؤ للجزيء = ( 11 ) .
تركيب لويس
للجزيء هو :
|
في هذه الصيغة انطبقت قاعدة الثمانية على الأكسجين ولم تنطبق على
النيتروجين حيث عدد الإلكترونات (
7
) أي يوجد الكترون منفرد، حتى قاعدة الثنائي لا تنطبق على النيتروجين لوجود
هذا الإلكترون المنفرد.
2- فوق أكسيد النيتروجين: وصيغته المختصرة
NO2
عدد الكترونات التكافؤ للنيتروجين
( 5 ) .
عدد الكترونات التكافؤ
للأكسجين
( 6 ) ، يوجد منه ذرتان إذن مجموع الكترونات الأكسجين ( 12 ) .
إذن مجموع الكترونات التكافؤ
للجزيء = (
5 + 12 =
17
) .
تركيب لويس
للجزيء هو :
|
انطبقت قاعدة الثمانية على الأكسجين .
لا قاعدة الثمانية ولا قاعدة الثنائي تنطبق على النيتروجين لوجود الإلكترون
المنفرد .
يوجد عدد محدود من المركبات المستقرة ذات الأعداد الفردية من الإلكترونات
ويمكن اعتبارها من الشواذ ومتوافقة مع المقولة المشهورة "
لكل قاعدة شواذ
" .
سادساً : تمثيل لويس للمجموعات الكيميائية
قلنا سابقاً أن ذرة العنصر حينما تكسب أو تفقد الكتروناً (
أو الكترونات
) تتحول إلى أيون سالب أو أيون موجب مثل :
 |
،
|
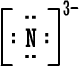 |
،
|
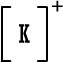 |
،
|
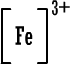 |
نسمي هذا النوع من الأيونات باسم الأيونات البسيطة إذن
الأيون البسيط : هو ذرة واحدة أصبحت مشحونة نتيجة كسبها أو فقدانها
لإلكترون واحد أو عدة الكترونات
.
يوجد مقابل هذا النوع البسيط من الأيونات أيونات تتكون من عدة ذرات
Polyatomic Ions
يمكن أن نطلق عليها اسم الأيونات المركبة أو الأيونات عديدة الذرات ، وهذه
الأيونات تتصرف كوحدة واحدة ولا تتجزأ عند دخولها في تفاعلات كيميائية
وتكوين روابط ، أي أنها تسلك سلوك الأيونات البسيطة . وأنت ربما تذكر وتعرف
بعضاً منها مثل : أيون الهيدرونيوم
+[
H3O
]
، أيون الأمونيوم
+[
NH4
]
، أيون الهيدروكسيد (
الذي يكوّن الشق السالب في القواعد
)
-[
OH
]
. وأيون الكربونات
|
[
CO3
]2-
|
الذي هو |
الشق السالب لمركب كربونات الكالسيوم الموجود في الطبيعة بعديد الأشكال
منها الحجر الجيري بأشكاله والطباشير والرخام .
نُسمي هذه الأيونات عديدة الذرات باسم
المجموعات
الكيماوية وهذه أيونات مركبة بالمقارنة مع الأيونات البسيطة التي تتكون من
ذرة واحدة .
وهذه الأيونات
تتصرف كوحدة واحدة ولا تتجزأ عند دخولها في تفاعلات كيميائية مع غيرها
وتكوين روابط ، أي أنها تسلك سلوك الأيونات البسيطة .
أمثلة على صيغ لويس للأيونات عديدة الذرات ( المجموعات الكيماوية ) .
اضغط على المثال لرؤية الحل
الخلاصة :
1.
الكترونات التكافؤ (
أو الكترونات الربط
) :
هي
الالكترونات التي تحتل المستوى الإلكتروني الخارجي للذرة .
2. إذا كان المستوى الإلكتروني الخارجي غير مكتمل ( غير ممتليء تماماً
بالإلكترونات ) فتكون العناصر قادرة على القيام
بتفاعلات
كيميائية وتكوين روابط ومركبات كيميائية مع غيرها ، وبالطبع يختلف نشاطها
من عنصر لآخر .
3. إذا كان المستوى الإلكتروني الخارجي مكتملاً ( ممتلئ تماماً
بالإلكترونات ) يكون نشاط العناصر ضعيفاً جداً ( إلى حد يكاد
يكون
معدوماً
) فلا تكون روابط ومركبات مع غيرها إلا بصعوبة وهذا هو حال المجموعة
الثامنة أو مجموعة الغازات النبيلة في الجدول الدوري .
4. يوجد في المستوى الخارجي الأبعد عن النواة في ذرة كل غاز نبيل ثمانية
الكترونات ( ما عدا الهيليوم الذي يمتلك الكترونين
فقط وهو
مستقر
بهما ) وهذه الغازات هي نموذج الاستقرار .
5. قاعدة الثمانية : تميل الذرات لفقدان أو كسب الإلكترونات أو المشاركة
بها بحيث تصبح محاطة بثمانية من الكترونات التكافؤ
( تصبح مشابهة للتركيب الإلكتروني للغازات النبيلة ) .
6. الإلكترونات الثمانية تعتبر أربعة أزواج من الكترونات التكافؤ وترتب حول
رمز العنصر عند كتابة رموز وتراكيب لويس .
سابعاً : ملخص رموز لويس أو الرمز للإلكترونات بنقط Electron-dot
Symbols
أ. تستخدم النقط للدلالة على الكترونات التكافؤ للذرات بحيث نرمز كل نقطة
لالكترون واحد .
ب. ترسم النقط حسب عددها ( أي حسب عدد إلكترونات التكافؤ ) حول الجهات
الأربع لرمز العنصر المتفق عليه دولياً .
ج. يستخدم رمز العنصر المتفق عليه دولياً ليعبر عن النواة والإلكترونات
الداخلية .
د. رموز لويس للأيونات الموجبة ( الأيونات الفلزية )
تفقد الفلزات الكترونات التكافؤ الخاصة بها وتتحول إلى أيونات موجبة .
Na .
|
←
|
[ Na ]+
|
|
. Mg
.
|
←
|
[ Mg
]2+
|
لاحظ أنه لم يعد يوجد الكترونات تكافؤ حول الأيون لذلك لا نجد نقطاً حول
الرمز .
هـ. رموز لويس للأيونات السالبة (
أيونات اللافلزات
) .
تكسب ذرات اللافلزات الكترونات لملء مدارها الأخير ولتصبح محاطة بثمانية
الكترونات وتتحول إلى أيونات سالبة .
←
|
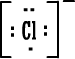 |
،
|
←
|
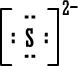 |
لاحظ أن أيون الكلوريد وأيون الكبريتيد أصبح لهما توزيعاً يشبه غاز الآرجون
النبيل .
الأيون
البسيط
Simple Ion
: هو ذرة فقدت الكتروناً (
أو الكترونات
) أو ذرة
كسبت
الكتروناً (
أو الكترونات
)
فأصبحت تحمل شحنة موجبة أو سالبة .
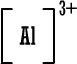 |
أو
|
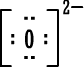 |
نميز المركبات الأيونية بسهولة من تركيبها فهي
تتكون من فلز (أيون موجب) ولا فلز (أيون سالب) .
و.
تستخدم تراكيب أو صيغ لويس للتعبير عن المركبات الأيونية مثلاً كلوريد
الصوديوم حسب لويس هو :
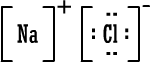 |
ولكن الأكثر شيوعاً هو التعبير عن المركب بطريقة مختصرة هي
NaCl
فهي أسهل .
ز.
تراكيب لويس للتعبير عن الجزيئات المتشابهة
والمركبات ذات الروابط التساهمية .
نعرف المركبات ذوات الروابط المشتركة أو التساهمية بسهولة
فهي
تتكون من لافلزات فقط .
نرسم الكترون في الرابطة على شكل نقطتين أو على شكل ( ـ ) .
نرسم الكترونات التكافؤ التي لم تشترك في الربط على شكل نقاط مزدوجة إلا
إذا كان عددها فردياً فيوضع أحدها منفرداً في هذه الحالة .
جزيء
الماء
|
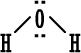 |
،
|
جزيء
أكسيد النيتريك
|
ح.
تراكيب لويس
للأيونات عديدة الذرات ( الأيونات المركبة
Polyatomic
Ions
) : هي أيونات تتكون
من ذرتين أو أكثر مرتبطة ببعضها بروابط تساهيمة بحيث تكون مجموعة مستقرة
وتسلك سلوك الأيونات البسيطة عند دخولها في تفاعلات كيميائية ، وهي تحمل
شحنة إما موجبة أو سالبة .
مجموعة
الأمونيوم
|
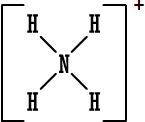 |
،
|
مجموعة
الهيدروكسيد
|
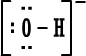 |
ويمكن للأيونات عديدة الذرات أن ترتبط مع
أيونات
عناصر مخالفة لها في الشحنة بروابط أيونية مثل
NaOH
حيث ترتبط مجموعة الهيدروكسيد السالبة مع أيون الصوديوم الموجب أي أن
المركب يتكون من أيونين أحدهما بسيط هو
+[
Na
]
والثاني
مركب
(
عديد الذرات
) هو
- [ OH ]
.
NH4Cl
كلوريد الأمونيوم وهو يتكون من
أيونين أيون بسيط هو
|
 |
، وأيون مركب هو |  |
ط.
لم تعد قاعدة الثمانية القاعدة الوحيدة لاستقرار الذرات ، بل أصبح
الاستقرار مرتبطاً بازدواج
الإلكترونات وقد يكون عدد الإلكترونات حول الذرة المستقرة من ( 2 ) ( زوج
واحد ) إلى ( 14 ) ( سبع أزواج ) .
أمثلة :
1.
جزيء
H2
مستقر بزوج الكتروني واحد ( يشبه ذرة الهيليوم ) .
2.
BeCl2
|
← |
زوجان
من الإلكترونات حول البيريليوم والجزيء مستقر بالرغم من عدم انطباق
|
قاعدة الثمانية على
البيريليوم .
3.
ثلاثة أزواج من الإلكترونات حول ذرة
البورون ( وهذا شذود عن قاعدة الثمانية )
ولكن المركب
معروف ومستقر تماماً .
BF3
|
←
|
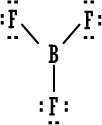 |
قاعدة الثمانية منطبقة بأربعة أزواج من الإلكترونات حول الفلور .
4. مركب
|
PCl5 |
←
|
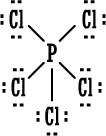 |
مركب خامس
كلوريد الفسفور مشهور وله استخدامات كثيرة في مجالات الكيمياء
المختلفة .
|
خمسة أزواج من
الإلكترونات حول ذرة الفوسفور وهذا شذوذ عن
قاعدة الثمانية ، أما على الكلور فتنطبق قاعدة الثمانية .
5. مجموعة
الكبريتات
:
|
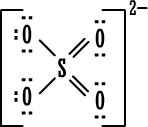 |
تنطبق قاعدة
الثنائي على ذرة الكبريت ، وعدد الإلكترونات حولها (12) حسب الصيغة
المقترحة لمجموعة الكبريتات. أما على الأكسجين فتنطبق قاعدة
الثمانية .
مجموعة الكبريتات
مركباتها مشهورة ويكفي أن نذكر منها حمض الكبريتيك .
|
6. مجموعة
فوق الكلورات :
|
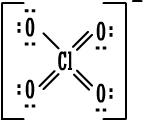 |
يوجد سبعة أزواج
من الإلكترونات حول ذرة الكلور .
مركبات مجموعة
فوق الكلورات مشهورة ، ويستخدم ملح فوق كلورات البوتاسيوم لتحضير
الأوكسجين .
|
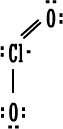 |
يوجد العديد من الجزيئات والمركبات التي تحوي
عدداً
فردياً من الإلكترونات وهي في حالة مستقرة ، وهذا شذوذ آخر عن قاعدة
الثمانية . مثل
مركب ثاني أكسيد الكلور
ClO2
.
|
التقويم :
أ- الروبيديوم
(
Rb)
من المجموعة الأولى .
ب- الباريوم
(
Ba
)
من المجموعة الثانية .
ج- الخارصين .
د- الجرمانيوم
(
Ge)
من المجموعة الرابعة .
هـ- الفضة .
و- اليود .
أ- الروبيديوم
(Rb
)
من المجموعة الأولى .
|
|
ب- الباريوم (
Ba
)
من المجموعة الثانية .
|
|
ج- الخارصين .
|
|
د- الجرمانيوم
( Ge)
من المجموعة الرابعة .
|
|
هـ- الفضة .
|
|
و- اليود .
|
أ- البوتاسيوم .
ب- الكالسيوم .
ج- أيون الجاليوم (
Ga
)
من المجموعة الثالثة .
د- أيوم البروميد
Bromide Ion
.
هـ- أيون الكبريتيد
Sulphide Ion
.
و- أيون الفوسفيدPhosphide
Ion [ P ]3-
أ- البوتاسيوم .
|
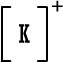 |
ب- الكالسيوم .
|
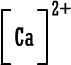 |
ج- أيون الجاليوم (
Ga
)
من المجموعة الثالثة .
|
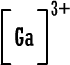 |
د- أيوم البروميد
Bromide Ion
.
|
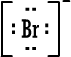 |
هـ- أيون الكبريتيد
Sulphide Ion
.
|
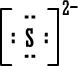 |
و- أيون الفوسفيدPhosphide
Ion [P]3-
|
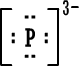 |
لأن مدارها
الخارجي ممتليء بثمانية الكترونات ومن الصعب الإضافة إليه أو السحب منه
(الهيليوم مداره الخارجي هو الأول وهو ممتليء بالكترونين . ويمكن اعتباره
أصل قاعدة الثنائي)
.

جميل جدا
ردحذفجزاك الله خير
ردحذفعنصرxرمزلويس الايونية(::x::) فإن عدد إلكترونات التكافؤ لهذا العنصر
ردحذفأزال المؤلف هذا التعليق.
ردحذف